Как найти температуру газа если известно давление

Конвертер величин
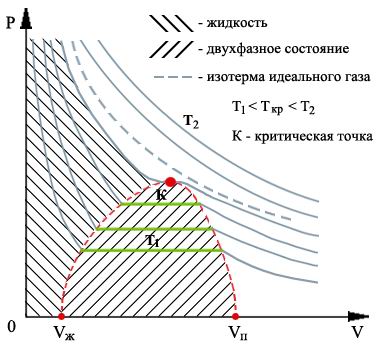
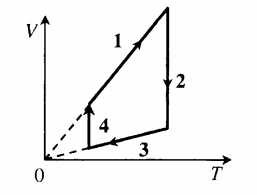
Экспериментальным путём зависимость давления газа от температуры при постоянном объёме установлена в году Шарлем и уточнена Гей-Люссаком в году. Термин «закон Шарля» распространён в российской учебной литературе для средних школ [1] [2] , но не встречается в более серьёзной литературе [3] [4]. Этот закон справедлив постольку, поскольку температура является мерой средней кинетической энергии вещества.







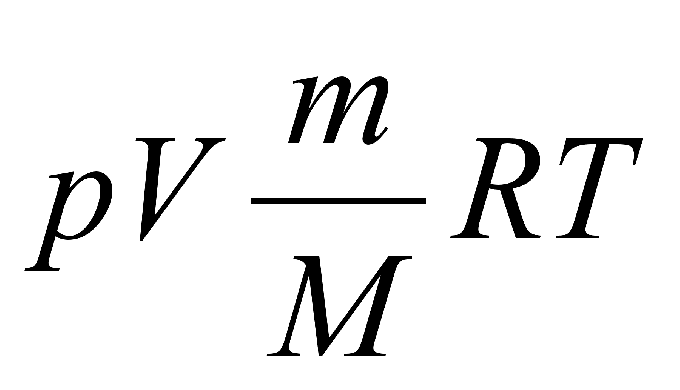

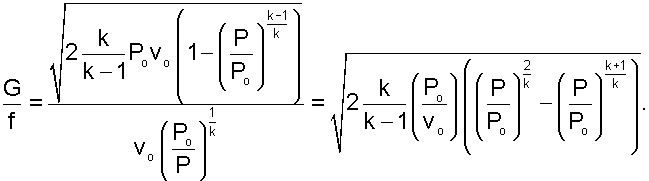

Ее называют постоянной Больцмана , в честь австрийского физика Л. Больцмана, одного из создателей молекулярно-кинетической теории. Постоянная Больцмана — одна из фундаментальных физических констант. Средняя кинетическая энергия хаотического движения молекул газа прямо пропорциональна абсолютной температуре.


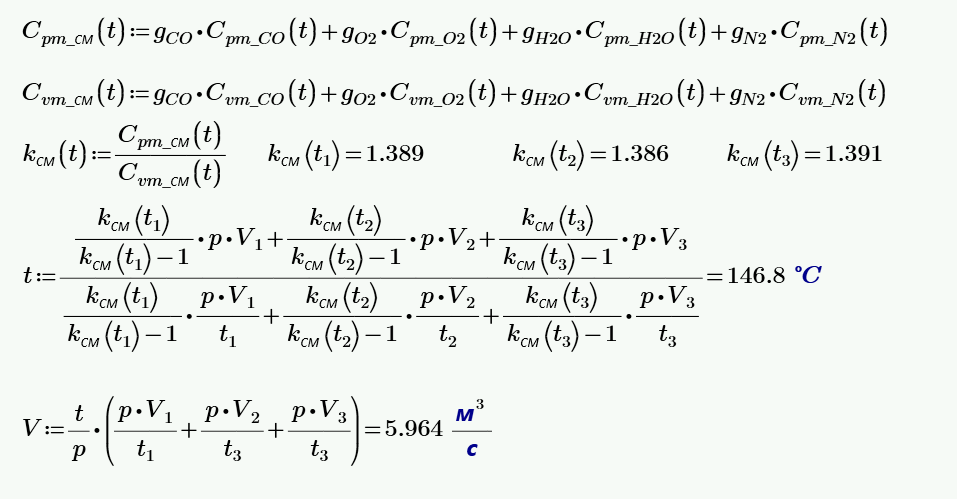
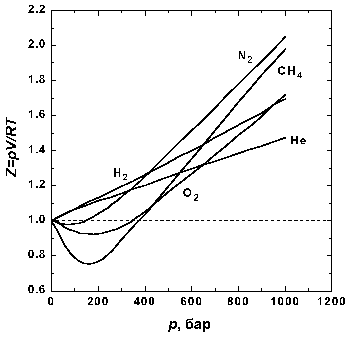



Уравнение имеет вид:. Последнее уравнение называют объединённым газовым законом. С точки зрения химика этот закон может звучать несколько иначе: объёмы вступающих в реакцию газов при одинаковых условиях температуре, давлении относятся друг к другу и к объёмам образующихся газообразных соединений как целые числа. Например, 1 объём водорода соединяется с 1 объёмом хлора , при этом образуются 2 объёма хлороводорода :.